Un logiciel de représentation de molécules, de structures cristallines et de propriétés dérivées de la distribution de charge
Auteurs: Théo Leduc, Vedran Vucovic, Eva Mocchetti, Christian Jelsch & Benoît Guillot, Université de Lorraine, Laboratoire de Cristallographie, Résonance Magnétique et Modélisations, CRM2, UMR CNRS-UL 7036
1. Introduction
MoProViewer [1] est le logiciel de visualisation moléculaire associé au programme MoProSuite [2], spécialisé dans l’affinement de structures cristallines ou de modèles de densité électronique à partir de données de diffraction des rayons X à haute résolution. La MoProSuite est constituée de deux modules principaux : MoPro, pour l’affinement cristallographique et VMoPro, destiné au calcul de propriétés dérivées de la distribution de charge. Au départ, MoProViewer a été conçu au laboratoire CRM2 pour permettre à un utilisateur de MoProSuite de configurer graphiquement un calcul par le module VMoPro. Depuis, de nombreuses fonctionnalités ont été implémentées et continuent de l’être à un rythme régulier, permettant d’utiliser MoProViewer indépendamment de MoProSuite. MoProViewer est développé dans l’objectif de permettre l’exploration de propriétés liées à la distribution de charge moléculaire en proposant une expérience utilisateur agréable et intuitive.
2. Visualisation de molécules et de structures cristallines
MoProViewer dispose de toutes les fonctionnalités attendues pour la représentation et l’étude de structures cristallines :
- Gestion des opérations de symétrie.
- Mesures de stéréochimie.
- Représentation des ellipsoïdes d’agitation thermique.
- Détection et représentation des liaisons hydrogène.
- Affichage des labels des atomes
- Etc
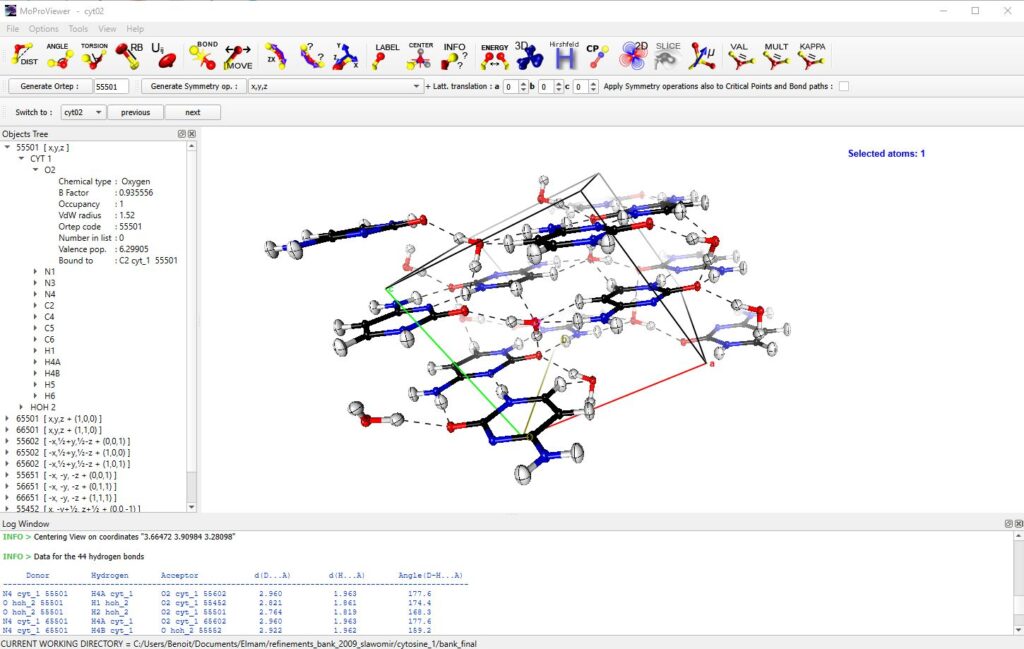
Il peut lire ou exporter les fichiers moléculaires aux formats CIF, PDB, XYZ, CUBE, et bien sûr au format PAR propre à MoProSuite. Son interface conviviale permet à l’utilisateur de facilement générer des molécules équivalentes par les opérations de symétrie du groupe d’espace, puis de naviguer entre elles grâce à un outil d’arborescence des objets décrivant le système affiché (figure 1). MoProViewer propose les modes de représentation standards : « lines », « balls & sticks », « cpk » et « cartoon » (pour les protéines). Tous sont hautement configurables. Des images haute résolution peuvent être exportées, dans une qualité compatible avec celle attendue pour une publication.
Figure 1 : Fenêtre principale de MoProViewer. Une portion du cristal de Cytosine monohydrate est affichée [3]. Les molécules équivalentes par symétrie dans et autour de la maille élémentaire sont représentées en mode « balls & sticks » avec les ellipsoïdes de déplacement thermiques à 50% de probabilité. L’arborescence des objets est visible à gauche, où les molécules symétriques sont identifiées par leurs codes ORTEP et leurs positions équivalentes. Dans la fenêtre d’information (en bas) sont affichées les données sur les liaisons hydrogène détectées par MoProViewer.
3. Suivi d’un affinement de densité électronique réalisé avec la MoProSuite
MoProViewer peut être considéré comme une interface graphique pour VMoPro. En quelques clics de souris, sur la base de la représentation de la molécule en cours d’affinement, l’utilisateur peut demander dans MoProViewer le calcul par VMoPro de n’importe quelle propriété qui lui est accessible. MoProViewer ensuite affiche le résultat du calcul. Les propriétés disponibles via VMoPro sont très nombreuses, allant de diverses densités électroniques (totale, de déformation, de valence etc…) aux propriétés dérivées telles que le potentiel électrostatique, le Laplacien de la densité électronique, l’énergie d’interaction électrostatique etc… Les modes de représentation dans MoProViewer sont soit en 2D (cartes en niveau de contour) ou en 3D (iso-surfaces de propriétés). MoProViewer dispose d’un grand nombre de fonctionnalités en termes de configuration de ces représentations (figures 2, 3, 4).
Figure 2 : Le dimère de Cytosine monohydrate est représenté. La molécule d’eau est entourée d’isosurfaces de potentiel électrostatique (contour négatif de -0.08 e/Å en rouge, positif de 0.1 e/Å en bleu). L’outil « 3D Maps Manager » est visible à droite. La densité électronique de déformation statique de la molécule de cytosine est représentée en cartes de contours dans l’outil de configuration dédié (à gauche), calculée dans le plan visible en vert. Les repères atomiques utilisés dans la modélisation multipolaire [4] sont visibles sur quelques atomes de la molécule de cytosine.
4. Propriétés dérivées de la distribution de charge
Outre son rôle d’interface pour le programme VMoPro, MoProViewer dispose d’un grand nombre de fonctionnalités qui lui permettent d’être utilisé de façon indépendante de la MoProSuite.
Calcul et exploration de champs scalaires
MoProViewer peut lire, exporter et afficher des isosurfaces de champs scalaires aux formats Gaussian, CUBE, XPLOR ou POSCAR. Il peut également calculer des champs scalaires de densité électronique sphérique et de potentiels électrostatiques Coulombien ou multipolaires générés par n’importe quelle sélection d’atomes des molécules représentées. Chaque « carte 3D » lue ou calculée apparait comme un onglet dans l’outil « 3D Maps Manager » (fig. 2), permettant d’afficher deux isosurfaces (typiquement une de valeur négative et une de valeur positive). Dans MoProViewer, chaque isosurface d’un champ scalaire donné peut être coloré en fonction des valeurs de n’importe quel autre champ scalaire. Ceci permet par exemple de très facilement réaliser des images de surfaces moléculaires colorées par le potentiel électrostatique (fig. 3).

(a)
(b)
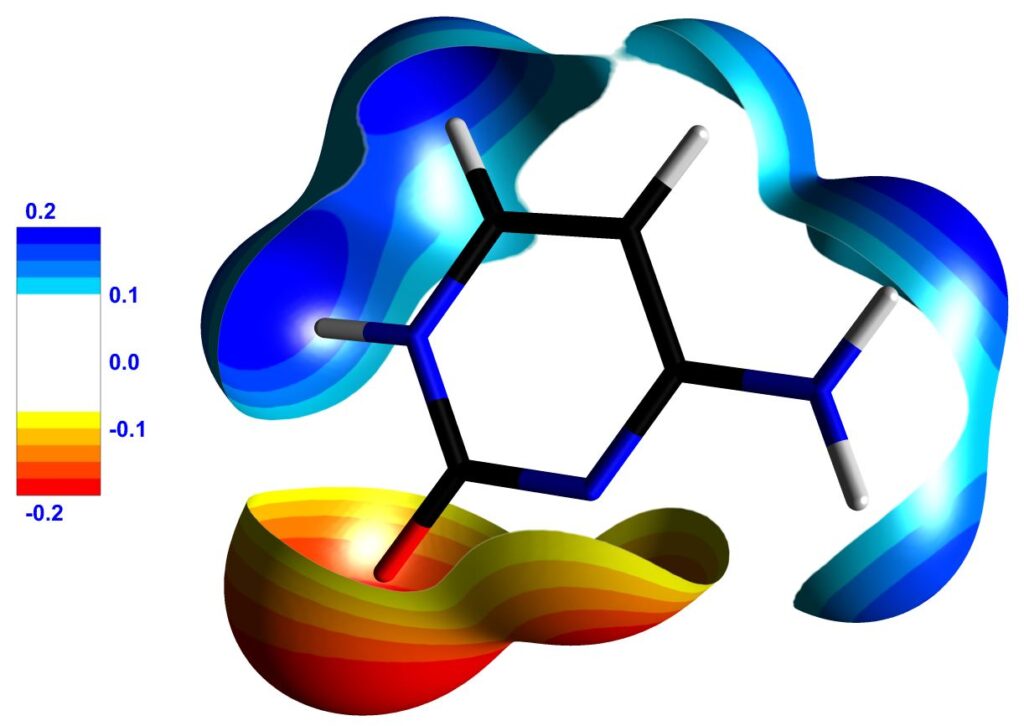
Figure 3 : (a) Molécule de cytosine représentée entourée d’une isosurface de 0.1 e/Å3 de densité électronique totale. La surface est colorée par le potentiel électrostatique généré par l’environnement cristallin. (b) Molécule de cytosine représentée entourée d’une isosurface de 0.05 e/Å3 de densité électronique totale, colorée par son propre potentiel électrostatique. Seules les régions de la surface où le potentiel est supérieur à 0.1 e/Å ou inférieur à -0.1 e/Å sont représentées, faisant apparaitre clairement ses sites électrophiles et nucléophiles. Les légendes portent sur les valeurs du potentiel électrostatique (en e/Å). Images exportées par MoProViewer.
Un outil très convivial d’exploration de champs scalaires est disponible dans MoProViewer, sous la forme d’un plan, d’une ligne ou d’un point déplaçable à la souris par l’utilisateur, permettant de représenter une coupe quelconque du champ scalaire, d’en tracer une courbe selon n’importe quelle direction, ou simplement d’en explorer la valeur en un point donné. Cet outil permet également de représenter les lignes de gradient du champ scalaire qui passent par l’objet manipulable. Dans le cas d’un champ scalaire de potentiel électrostatique, MoProViewer permet donc d‘étudier graphiquement, et quantitativement, la topographie des lignes de champ électrique (fig. 4).
(a)
(b)
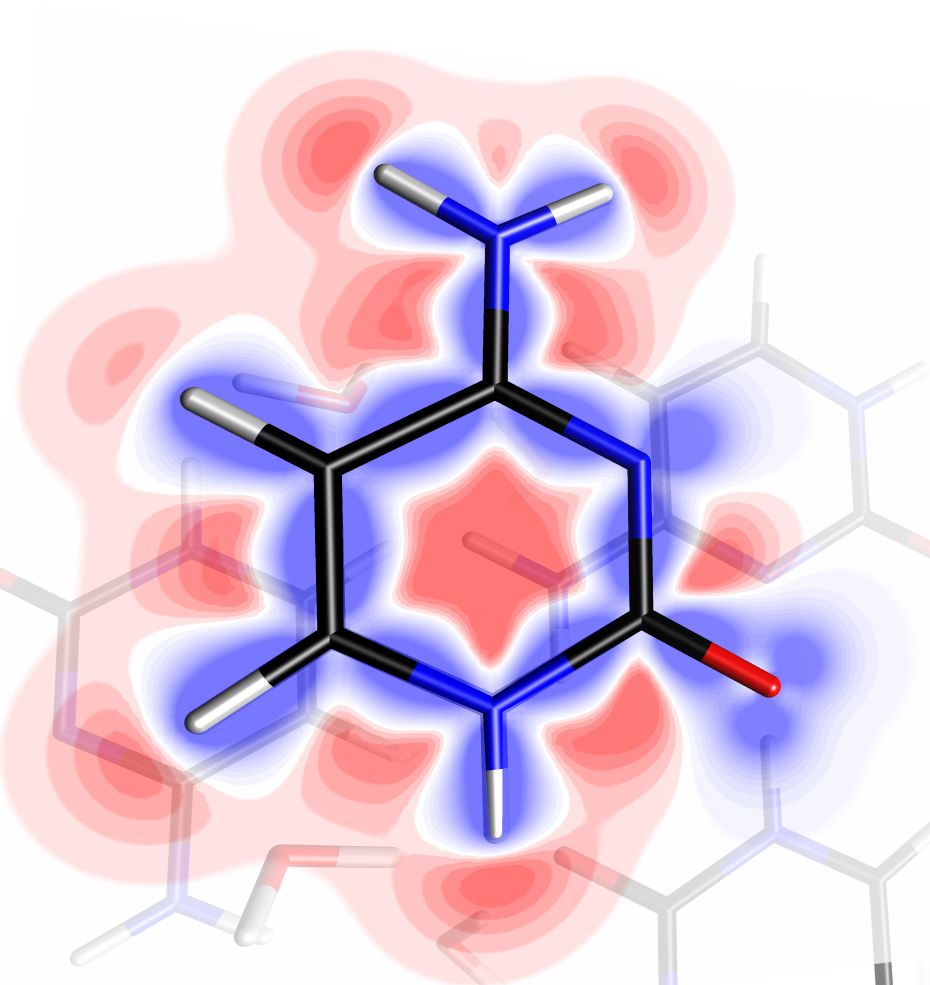
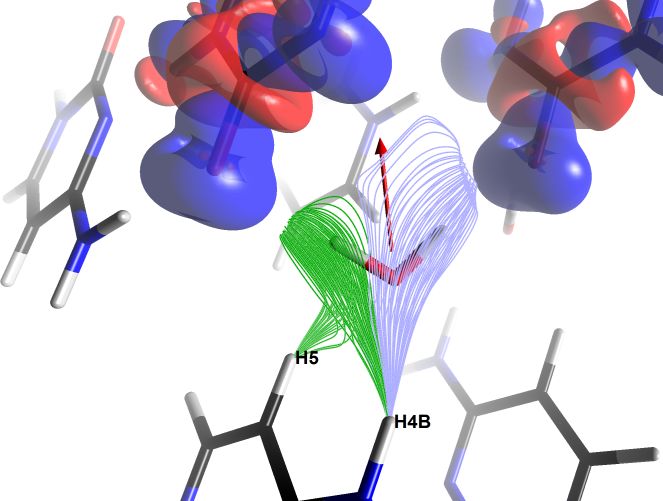
Figure 4 : (a) Densité électronique de déformation statique représentée pour une molécule de cytosine dans le cristal à l’aide de l’outil d’exploration de champs scalaires. La densité est projetée sur un plan de coupe translucide, négative en rouge et positive en bleu. Les contours visibles sont d’environ ±0.3 e/Å3. (b) Lignes de champ électrique auxquelles est soumise une molécule d’eau dans le cristal de cytosine monohydrate. Deux faisceaux de lignes sont représentés, créés à l’aide de deux instances de l’outil d’exploration de champ scalaire. Les lignes émanent des atomes H5 et H4B d’une molécule de cytosine, et convergent vers des paires d’électrons libres d’atomes d’oxygène des groupements carbonyle de deux autres molécules (dont les densités électroniques de déformation statiques sont représentées en isosurfaces translucides de valeurs ±0.05 e/Å3). On constate le relatif alignement des lignes de champ électrique avec le moment dipolaire de la molécule d’eau, représenté en rouge (échelle 3.3 Å/e̝Å, valeur 0.48 eÅ soit 2.3 D). Images exportées par MoProViewer.
Topologie de la densité électronique
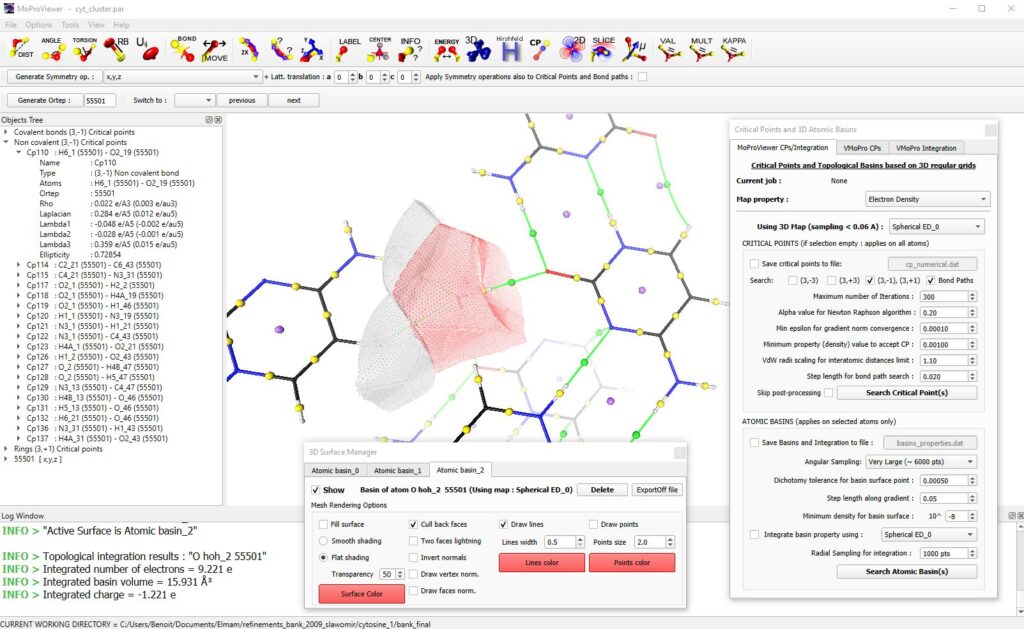
MoProViewer permet l’analyse topologique dans le cadre de la théorie Quantum Theory of Atoms In Molecules (QTAIM) [5], à partir d’un champ scalaire de la densité électronique totale préalablement du d’un fichier CUBE par exemple, ou calculé par MoProViewer. La recherche des points critiques et des basins topologiques se fait numériquement et rapidement grâce à la parallélisation de l’algorithme. MoProViewer permet de représenter les points critiques, les chemins d’interaction et les bassins topologiques. L’intégration de n’importe quel champ scalaire dans les bassins atomiques est également disponible (fig. 5).
Figure 5 : Une portion du cristal de cytosine monohydrate et représentée. Les points critiques de liaisons covalentes sont représentés en jaune, ceux de liaisons hydrogène en verts, et les points critiques de cycle sont en bleu. Les points critiques apparaissent dans l’arborescence des objets visible à gauche. Trois bassins topologiques sont représentés en mode « wireframe » : ceux d’un atome d’oxygène d’une molécule d’eau (en rouge) et ceux de deux atomes d’hydrogène d’une molécule de cytosine voisine. Dans la fenêtre d’information (en bas) sont visibles les informations d’intégration de la densité électronique dans le bassin de l’atome d’oxygène. L’outil d’analyse topologique est visible à gauche, et l’outil de gestion des bassins atomiques est visible en bas.
Transfert et polarisation de la densité électronique
Le CRM2 a développé une librairie de paramètres multipolaires expérimentaux décrivant la densité électronique moyenne et la polarisabilité anisotrope de nombreux types d’atomes rencontrés dans les molécules organiques [6]. Ces paramètres peuvent être transférés sur une structure dont les types d’atomes sont compatibles, pour obtenir très rapidement un modèle fiable de sa distribution de charge totale, incluant les polarisabilités atomiques. MoProViewer dispose d’un outil de transfert spécialement adapté aux structures de protéines (« Beluga » [7]). Cet outil permet également, grâce aux transférabilités, de calculer l’induction dipolaire mutuelle entre deux sélections d’atomes, comme par exemple entre une protéine et son ligand (fig. 6).
Figure 6 : un ligand de la protéine Panthotenate Synthetase (code pdb : 1N2J) est représenté dans son site de fixation, avec la densité électronique d’induction dipolaire montrée en isosurfaces de ±0.02 e/Å3. Cette densité électronique est représentée en rose là où le phénomène de polarisation a mené à une accumulation de densité électronique, et en vert dans le cas contraire. Les tenseurs de polarisabilité atomique des acides aminés à proximité du ligand sont représentés sous forme d’ellipsoïdes.
Calculs rapides d’énergies d’interaction électrostatique
Un modèle de densité électronique multipolaire (par affinement ou par transfert) permet le calcul d’énergies d’interaction électrostatiques. MoProViewer dispose d’un outil de calcul très rapide de ces énergies (« Charger » [8]) entre deux sélections quelconques d’atomes du système représenté. Cet outil est particulièrement adapté aux systèmes protéine-ligand, et permet de déterminer, en particulier, les contributions à l’énergie d’interaction électrostatique de chaque acide aminé (fig. 7).
Figure 7 : La structure de la protéine Panthotenate Synthetase représentée en mode « cartoon ». Le ligand est en rouge et seuls les deux résidus qui contribuent le plus à la stabilisation électrostatique du ligand sont représentés. L’outil de calcul rapide des énergies d’interaction est visible à droite, avec en vert la contribution de GLN70. Le calcul des contributions des 574 acides aminés à l’énergie d’interaction électrostatique totale entre la protéine et le ligand prend une dizaine de secondes sur un Intel® Core i7 récent.
4. Références
[1] B. Guillot, E. Espinosa, L. Huder and C. Jelsch. Acta Cryst. (2014). A70, C279.
[2] B. Guillot, L., Viry, R., Guillot, C., Lecomte, C., & Jelsch. J. Appl. Cryst (2001) A34, 214-223; C. Jelsch, B. Guillot, A. Lagoutte and C. Lecomte J. Appl. Cryst. (2005). 38, 38-54.
[3] P. Munshi & T.N. Guru Row. Acta Cryst. (2006). B62, 612-626.
[4] N. K. Hansen & P. Coppens. Acta Cryst. (1978). A34, 909-921.
[5] R. W. F. Bader (1990) Atoms in Molecules: A Quantum Theory. Oxford University Press, Oxford.
[6] S. Domagała, B. Fournier, D. Liebschner, B. Guillot, C. Jelsch Acta Cryst. (2012) A68, 337-351.
[7] T. Leduc, E. Aubert, E. Espinosa, C. Jelsch, C. Iordache, B. Guillot. J. Phys. Chem (2019) A123, 7156-7170.
[8] V. Vuković, T. Leduc, Z. Jelić-Matošević, C. Didierjean, F. Favier, B. Guillot, C. Jelsch Acta Cryst. (2021). D77, 1292-1304.